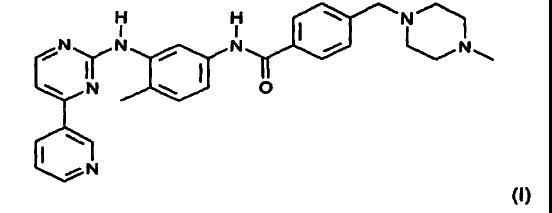
格列卫是瑞士诺华公司研发的用于治疗慢性髓性白血病的重磅药品,【1】其活性成份为“甲磺酸伊马替尼”( S T I 5 7 1 )。对该化合物,诺华公司早在1 9 9 3年就在我国提出了发明专利申请,并于1 9 9 9年获得授权,【2】直至2013年专利期限届满而失效。而在治疗白血病之外,诺华公司还发现甲磺酸伊马替尼(S T I 5 7 1 )可用于治疗胃肠基质肿瘤(G I S T),故又提出一项制药用途专利申请,请求保护S T I571在制备用于治疗G
I S T的药物组合物中的用途。
在获得上述制药用途专利( 以下称涉案专利)后,诺华公司对江苏豪森药业集团有限公司(简称豪森公司)发起了侵权诉讼,豪森公司则以请求宣告涉案专利无效的方式作为反击。经过国家知识产权局专利复审委员会(简称专利复审委)五人合议组的审理,涉案专利因不具备创造性而被宣告无效,该认定也在后续的行政诉讼中得到了一、二审法院的支持。
该案被评为“ 2 0 1 5 年度专利复审无效十大案例”,无论是专利复审委的认定意见,还是后续一、二审法院的判决论理,乃至各方当事人的诉辩主张,都极具代表性,可以作为研究制药用途专利确权审查的典型案例。
案情简介
涉案专利名称为“胃肠基质肿瘤的治疗”,专利号为0 1 8 1 7 8 9 5 . 2 ,申请日为2 0 0 1 年1 0 月2 6 日, 优先权日为2 0 0 0 年1 0 月2 7 日, 授权公告日为2 0 0 6 年9 月2 7日,授权公告时的权利要求为:
“ 1 . 具有通式I 的4 - ( 4 - 甲基哌嗪- 1 - 基甲基) -N - [ 4 - 甲基- 3 - [ ( 4 - 吡啶- 3 - 基) 嘧啶- 2 - 基氨基]苯基] -苯甲酰胺或它的可药用盐在制备用于治疗胃肠基质肿瘤的药物组合物中的用途。”
上述权利要求中的“ 4 - ( 4 - 甲基哌嗪- 1 - 基甲基) - N - [ 4 - 甲基- 3 - [ (4-吡啶-3-基)嘧啶-2-基氨基]苯基]-苯甲酰胺”即为伊马替尼,其甲磺酸盐就是甲磺酸伊马替尼( S T I 5 7 1 )。
2014年9月5日,豪森公司向专利复审委提出无效宣告请求,认为涉案专利不具备新颖性、创造性,主要依据是其提交的证据1,即一篇刊载于《柳叶刀·肿瘤学》2000年10月刊上的综述性文献——《软组织肉瘤的治疗:综述与更新》。该文中有如下内容:“只要有可能,就应该使用临床试验中有前景的新药治疗这些患者。这类对初始化疗耐药的肉瘤包括,例如,胃肠基质肿瘤(G I S T)……考虑到传统的采用细胞毒类化学疗法治疗软组织肉瘤的局限性,新的治疗途径应该会受到医生的欢迎,也会受到患者及其家人的欢迎。幸运的是,研究使人们对这类肿瘤的生物学和病理生理学有了全新的理解,而这可以应用于新的治疗策略。一个更有前景的例子是……其它的新疗法包括合理的靶点,如组成性激活的c
- k i t受体酪氨酸激酶,它表征众所周知的化疗耐药的胃肠基质肿瘤。在本文写作之时,一项选择性酪氨酸激酶抑制剂S T I 5 7 1 针对G I S T的试验已经刚刚在达纳-法伯癌症研究公司开始(与全球其他的研究中心合作),非常早期的结果看起来令人兴奋。”
此外,豪森公司提交的证据2 、5 、6 ,即三篇在本专利优先权日之前的文献资料,在一、二审诉讼中也成为了各方争议的焦点,其中记载了c - k i t 基因突变与G I S T发病之间的关系、S T I571能够有效抑制c - k i t激酶活性等内容,所涉及的法律问题是本领域技术人员知识和能力的界定。
在整个案件的审理过程中,证据1是否可以作为现有技术的问题,始终是各方争辩的焦点,也是涉案专利后续新颖性、创造性审查的基础,颇具看点。在刊载证据1的《柳叶刀·肿瘤学》期刊上,仅标注“ 2 0 0 0年1 0月刊”,而未载明具体到“日”的公开发行日期。而涉案专利的优先权日为2 0 0 0 年1 0 月2 7 日, 使得在该优先权日之前,证据1是否已经实现了专利法意义上的“公开”,就成为了认定现有技术的关键。豪森公司和诺华公司在本案中均提交了大量证据,专利复审委、一审和二审法院均认可证据1可以作为现有技术使用。【3】不过,由于该争议仅属于个案事实问题,本文不再展开,而是着重探讨以下两个方面的法律问题。
本领域技术人员的知识和能力
在专利授权确权审查中,“本领域技术人员”是一类拟制的主体,审查时假定从其所具备的知识和能力出发,对相关技术方案的可专利性进行判断。本案中,有关本领域技术人员所应具备的知识和能力问题,在无效审查阶段并未出现。但诺华公司在提起行政诉讼时主张,“本领域技术人员对G I S T的发病机理和诊断方式知之甚少,认知水平较低”,无法对“采用S T 1 5 7 1 治疗G I S T ”产生合理的成功预期。作为回应,专利复审委员会和豪森公司均主张证据2、5
、6 可以佐证本领域技术人员的知识和能力。诺华公司则认为,虽然证据2、5 、6属于涉案专利优先权日前的现有技术,但并非本领域的普通技术知识,故不属于本领域技术人员应当知晓的技术知识。这也使得本领域技术人员的知识和能力问题,成为本案无法回避的争议焦点。
事实上,对于本领域技术人员所应具备的知识和能力,历次《审查指南》都有明确规定。相比较而言,《审查指南1 9 9 3 》对本领域技术人员设定的知识和能力水平,【4】要明显高于之后的《审查指南2006》和《专利审查指南2010》,【5】 因为前者规定本领域技术人员知晓发明所属技术领域“所有的”现有技术,而后者仅要求知晓所属技术领域所有的“普通”技术知识,二者之间的差异显而易见。显然,1 993年版的规定更有利于无效请求人,因为从更高水平的本领域技术人员角度出发,更容易得出发明创造不具备创造性的结论;对于专利权人而言,则更青睐2006年和2010年版的规定。同时鉴于涉案专利的优先权日为2
0 0 0 年1 0 月2 7 日,故豪森公司主张本案应适用1993年版的规定,诺华公司则主张适用2006年和2010年版的规定。
一、二审法院最终都采取了2 0 0 6 年和2 0 1 0 年版《审查指南》所规定的标准。二审法院还就此进行了专门论述:“ 我国关于新颖性、创造性的认定标准从未发生改变,在此情况下,对所属技术领域人员的知识和能力的认定,应当坚持同一标准。假定本领域技术人员知晓发明所属技术领域所有的现有技术,是不合理的设定,对本领域技术人员设定了过高的知识和能力。就此而言,《审查指南2 0 0 6 》和《专利审查指南2 0 1 0 》中关于所属技术领域人员的知识和能力的规定更为合理,我国现行专利审查实践及司法实践中均执行这一标准,因此,根据《行政诉讼法》第六十三条第三款关于‘人民法院审理行政案件,参照规章’之规定,本院在本案中参照《审查指南2006》和《专利审查指南2010》中的有关规定来确定本领域技术人员的知识和能力。”尽管如此,一、二审法院仍在对本领域技术人员知识和能力的认识上出现了分歧。
一审法院认为,本领域技术人员是指知晓申请日或优先权日之前发明所属技术领域所有的普通技术知识,能够获知该领域中所有的现有技术,并且具有应用该日期之前的常规实验手段的能力的人员。证据2、5、6属于涉案专利的现有技术,其中所披露的信息【6】是本领域技术人员无需付出创造性劳动即可获得的知识,故已在本领域技术人员的认知范围之内。
二审法院不同意一审法院观点,其认为本领域技术人员的知识和能力分为几个层次:首先,本领域技术人员知晓申请日或者优先权日之前发明所属技术领域所有的普通技术知识,即技术常识,亦称公知常识。其次,本领域技术人员也能够获知所属领域中所有的现有技术。但“ 能够获知”只表明本领域技术人员根据技术需求,有能力去获知相关的技术知识,并不表明其知晓该技术知识。“能够获知”与“知晓”是不同的,本领域技术人员知晓的技术知识仅限于现有技术中的普通技术知识,而不包括所有的现有技术。再次,本领域技术人员具有应用申请日或者优先权日之前常规实验手段的能力,但不具有创造能力。在此基础上,同时鉴于各方当事人均认可证据2、5
、6不属于本领域的公知常识性证据,而仅是稍早于涉案专利优先权日的期刊文章,并考虑到医学、药学属于知识更新并不太快的领域,【7】二审法院认为一审法院根据证据2 、5 、6来确定本领域技术人员知识和能力的做法并不妥当。
进一步分析一、二审判决还可看出,一审判决中的本领域技术人员无疑具有更高的认知水平,因为即便是不属于本领域普通技术知识的现有技术,只要是无需付出创造性劳动即可获得( 例如文献检索),那么也可纳入到本领域技术人员的“ 认知范围”。但该标准也容易引发质疑,因为这在一定程度上相当于以“ 能够获知”之名,将所谓的佐证本领域技术人员知识和能力的证据( 即证据2 、5 、6 ),实质上作为了与最接近现有技术相结合并用以评价创造性的现有技术(
即证据1 + 证据2 、5 、6 ),而这并非是无效请求人所主张的现有技术结合方式。此外,该标准还可能导致本领域技术人员的知识和能力因为个案证据的不同而出现高低波动。因此就总体而言,二审法院的标准更加合理,本领域技术人员所“ 知晓”的应当仅是本领域的普通技术知识。至于其“能够获知”相关技术的能力,应理解为本领域技术人员在需要对现有技术做出改进时,具有检索其他现有技术并将其与需要改进的现有技术进行“ 结合”的能力。依此标准,“ 能够获知”的内容显然不属于本领域技术人员所知晓的范畴。
制药用途专利的新颖性和创造性
涉案专利系保护S T I571在制备用于治疗G I S T 的药物组合物中的用途,此种对制药用途的保护也是医药专利领域的重大特色之一。
(一)如何保护物质的医药用途?
涉案专利权利要求的内容可以抽象概括为“化合物X在制备用于治疗Y疾病的药物中的用途”,这是典型的“瑞士型权利要求”( S w i s s - t y p e c l a i m )的撰写方式,因其最早出现于瑞士工业产权局而得名。
之所以要撰写成“ 瑞士型权利要求”,是由于包括我国在内的世界绝大多数国家对疾病的治疗方法并不提供专利保护,故对实质上为药物用于治疗某疾病的发明创造,在寻求专利保护时就需在权利要求撰写方式上作适当变通。至于接受此种变通的原因,最高人民法院曾在判决中进行过阐释:“为了保护发明人对于现有技术的创新性贡献, 实现专利法保护创新、鼓励发明创造的立法宗旨…… 允许将那些发明实质在于药物新用途的发明创造, 撰写成制药方法类型的权利要求来获得专利权……其实质上是针对物质的医药用途发明创造所做的特别规定,通过给医药用途发明创造提供必要的保护空间和制度激励,平衡社会公众与权利人的利益。”【8】
(二)新颖性:如何理解“治疗Y疾病”特征?
如果进一步细分,“ 瑞士型权利要求”包括三个特征:( 1 )化合物X ;( 2 )化合物X制备成药物;( 3 )治疗Y 疾病。本案中,对于如何理解“ 治疗Y 疾病”(本案中即为治疗G I S T )的特征,各方产生了分歧,因为这直接关乎权利要求1相对于证据1是否具备新颖性。
从前述证据1公开的内容可知,全球范围内已经开展S T I 5 7 1 针对G I ST的试验,并取得了令人兴奋的早期结果。但需注意的是,证据1 中并未明确指出上述试验为临床试验,进而也无法得出临床试验已获得肯定结果的结论。
豪森公司主张,“治疗G I S T”应理解为在体外细胞实验、或动物模型实验、或临床实验中具有抑制/治疗GI ST的效果,因为专利法意义上的制药用途不同于C F D A的药品评审,临床试验结果的确认不是必须的,只要做到体外细胞实验或动物模型实验验证药效即可,因此证据1 足以破坏涉案专利的新颖性。诺华公司则主张,该特征应理解为“临床上有效或成功治疗胃肠基质肿瘤患者”,由于证据1 没有给出临床有效的明确结论,故涉案专利相对于证据1具备新颖性。
专利复审委经审查认为,“治疗G I S T”应当理解为“有效治疗胃肠基质肿瘤患者”,否则对化合物的医药用途进行专利保护没有意义。即使是在说明书未记载临床试验情况的情形下,“治疗Y疾病”也不应被解释为“关于Y疾病的体外细胞实验有效”或“关于Y 疾病的动物模型试验有效”。本案中,由于证据1并未明确或隐含公开所进行的是临床实验,也未反映出S T I 5 7 1能够有效治疗G I S T的明确结论,因此权利要求1相对于证据1具备新颖性。虽然双方当事人对该认定均无异议,使得后续的行政诉讼也未涉及,但专利复审委对“治疗Y疾病”这一特征作出的认定仍然具有指引意义,笔者亦表认同。
(三)创造性:如何理解医药领域的改进动机?
鉴于医药领域较为特殊的实验属性和难以预期性,并具体在制药用途发明创造的情形,现有技术如果仅有空泛的或断言式的结论,即使这可能会使本领域技术人员考虑尝试用“ 化合物X ”来“ 治疗Y 疾病”,也不宜仅据此即认定本领域技术人员会产生对现有技术进行改进的动机,原因就在于前述医药领域的难以预期性。但如果现有技术中存在充分的技术信息,为改进现有技术指明了方向,并能使本领域技术人员对该种改进形成“成功预期”,那么此时就可以认为现有技术已经给出了足够的教导和启示,本领域技术人员因此也有动机对现有技术做出改进。
诺华公司主张,抗肿瘤药物研发具有高度的不确定性,证据1 没有给出临床试验成功的数据,而仅是“非常早期的结果看起来令人兴奋”的泛泛表述,无法使本领域技术人员对“采用ST I571治疗G I S T”具有合理的成功预期,也不会产生“专利法意义上的动机”。
一审法院认为,首先,证据1 已载明传统的细胞毒类化学疗法对G I S T类的软组织肉瘤治疗效果不佳,因此只要在临床试验中具有一定应用前景的新的治疗途径出现,本领域技术人员就会有动机去尝试。其次,本领域技术人员基于在专利申请日前已获知的信息能够认识到, c - k i t基因突变是G I S T发病的重要原因, 因此抑制c - k i t基因突变属于新的治疗途径。再次,“ 令人兴奋”的表述会使本领域技术人员产生足够的动机,促使其将S
T I 5 7 1 用于G I S T治疗并具有合理的成功预期。另外,正是由于肿瘤药物研发的复杂性, 才会使本领域技术人员对一些积极信息产生更多关注,并据此进行有益的尝试。因此,虽然证据1未明确公开具体的实验类型和实验数据, 但结合本领域技术人员的认知能力和证据1中的描述,本领域技术人员无需付出创造性劳动即能得到涉案专利的技术方案。
二审法院的思路与一审法院大致相同,但由于二审法院对本领域技术人员知识和能力的界定不同于一审法院,故在“成功预期”的论述上稍有不同。具体而言,一审法院借助本领域技术人员从证据2、5 、6 中所能获知的信息,将证据1中“S T I 5 7 1 治疗G I S T”的内容,从病理机制层面进行了阐释和完善,从而论证了为什么会形成“ 合理的成功预期”。二审法院由于不认可本领域技术人员具有上述认知,因此仍然是从证据1本身出发,认为“证据1的作者推测组成性激活的c
- k i t 受体酪氨酸激酶是合理的靶点,这条治疗途径属于新的治疗途径,加之实验范围已经扩大到与全球其他的研究中心合作,以及作者对于‘非常早期的结果看起来令人兴奋’的记载,本领域技术人员得到的信息是采用S T I 5 7 1 治疗G I S T是具有合理的成功预期的”。可以看出,尽管最终得到了相同的结论,但由于缺乏病理机制等方面的内容支持,二审法院更多是结合其他方面积极信息对本领域技术人员的教导和启示,来论证为什么会形成“合理的成功预期”,这也是一、二审法院在论述逻辑上的差异所在。还需注意的是,对于“成功预期”的程度,二审法院进一步明确指出,“创造性判断中只需要对成功具有合理的预期即可,并不需要绝对的成功预期”,这也正是专利创造性审查与注重安全性、有效性的药品审批的不同之处。【9】
本期涉及的是专利行政案件,下期将介绍一起专利侵权民事案件。
注释:
1 电影《我不是药神》中“格列宁”的原型就是格列卫。
2 诺华公司甲磺酸伊马替尼化合物专利的专利号为93103566.X。
3 具体可参见国家知识产权局专利复审委员会第27371号无效宣告请求审查决定书、北京知识产权法院(2016)京73行初985号行政判决书、北京市高级人民法院(2017)京行终2871号行政判决书。
4 《审查指南1993年》规定:“所属技术领域的技术人员与审查员不同,他是一种假想的人,他知晓发明所属技术领域所有的现有技术,具有该技术领域中普通技术人员所具有的一般知识和能力,他的知识水平随着时间的不同而不同。”
5 《审查指南2006》、《专利审查指南2010》规定:“所属技术领域的人员,也可称为本领域的技术人员,是指一种假设的‘人’,假定他知晓申请日或者优先权日之前发明所属技术领域所有的普通技术知识,能够获知该领域中所有的现有技术,并且具有应用该日期之前常规实验手段的能力,但他不具有创造能力。”
6 即前文所述c-kit基因突变与GIST发病之间的关系、STI571能够有效抑制c-kit激酶活性等内容。
7 对于二审法院“医学、药学属于知识更新并不太快的领域”的认定,笔者持保留意见。
8 参见最高人民法院(2012)知行字第75号行政判决书。
9 《药品注册管理办法》第三条规定:“药品注册,是指国家食品药品监督管理局根据药品注册申请人的申请,依照法定程序,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。”最高人民法院在(2014)知行字第67号行政裁定书中也曾明确指出:“虽然证据2公开的是Ⅰ期临床试验,但在证据2公开的基础上,本领域技术人员容易想到可以以1.0mg剂量来治疗乙肝病毒感染。被诉决定认为证据2无法确定1.0mg剂量是能够有效治疗乙肝病毒感染的剂量,进而认定非显而易见不妥。虽然I期临床研究是用于评价安全性,在阅读了证据2之后,本领域技术人员不知道1.0mg剂量对于治疗是否有效,但并不意味着证据2没有给出相应的技术启示。”